Badania wykazały, że tlenoterapia hiperbaryczna (HBOT) poprawia czynność serca głównie poprzez zmniejszenie stresu tlenowego, regulację metabolizmu energetycznego i hamowanie apoptozy komórek.
Efekty kardioprotekcyjne HBOT są oceniane głównie przez ELISA, sondy fluorescencyjne, transmisyjną mikroskopię elektronową i odwrotną transkrypcję-ilościową PCR (RT-qPCR).
Jak zaobserwowano w transmisyjnym mikroskopie elektronowym, użycie komory hiperbarycznej 0,25 MPa dla HBOT przez 14 dni (raz dziennie) poprawiło morfologię mitochondriów i zmniejszyło liczbę pęcherzyków autofagicznych.
HBOT znacznie zwiększył poziomy otwarcia ATP, ADP, ładunku energii i porów przejściowych przepuszczalności mitochondriów, ale zmniejszył poziom AMP, cytochromu c i reaktywnych form tlenu, który został określony za pomocą RT qPCR lub immunohistochemii. Ponadto HBOT znacznie zwiększył poziom ekspresji genu lub białka białka białka białka białka wiążącego białko 1 eIF4E, ssaka docelowego rapamycyny (mTOR), mitochondrialnego DNA, podjednostki 1 dehydrogenazy NADH, mitofuzyny 1 i mitofuzyny 2, podczas gdy zmniejszał poziom ekspresji genu lub białka związanego z autofagią 5 (Atg5), cytochromu c, białka związanego z ruchliwością 1, I p53.
Dane wyrażane są jako średnia ± SD (n = 5). * P <0,05; ** P <0,01; *** P <0,001.
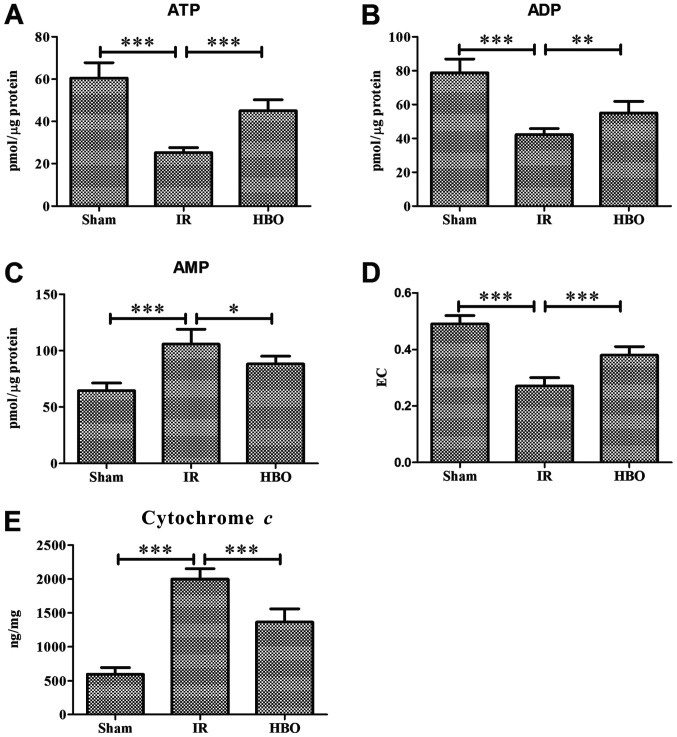
(ABD) ATP, ADP, EC są określane w grupie Sham, grupie IR i grupie HBO.
(CE) Użyj zestawu ELISA do wykrywania w grupie Sham, grupie IR i grupie HBO
HBO, tlen hiperbaryczny; EC, ładunek energetyczny; IR, niedokrwienie/reperfuzja.
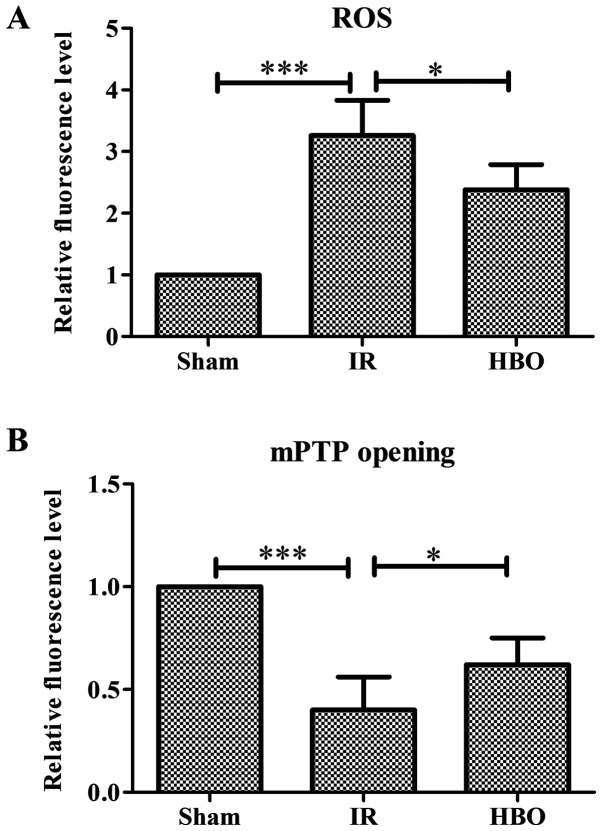
HBO, tlen hiperbaryczny; RFT, reaktywne formy tlenu; mPTP, porów przejścia przepuszczalności mitochondrialnej; IR, niedokrwienie/reperfuzja; DHE, dihydroetidium.
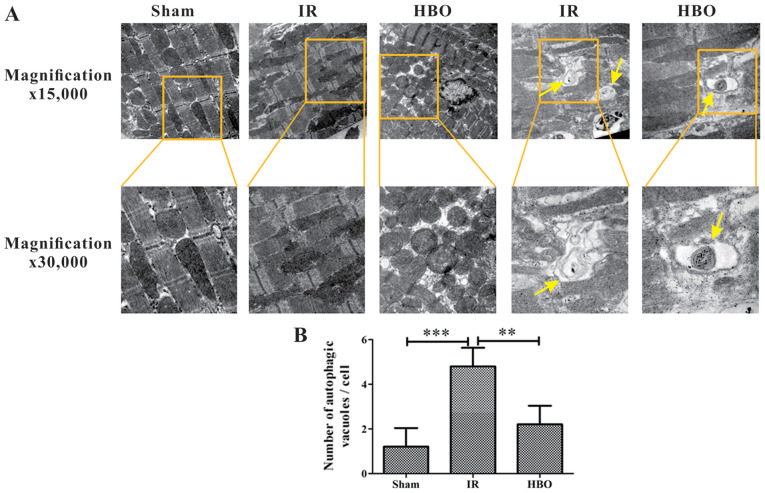
(A) Reprezentatywne fotomikrografy tkanki mięśnia sercowego w grupie Sham, IR i grupie HBO. Mitochondria w grupie Sham były normalne i nie zaobserwowano pęcherzyków autofagicznych. W porównaniu z grupą Sham zaobserwowano znaczne uszkodzenia mitochondriów i wzrost liczby wakuoli autofagicznych w grupie IR. W porównaniu z grupą IR zaobserwowano tylko niewielkie uszkodzenia mitochondriów i spadek liczby pęcherzyków autofagicznych (zmiany koncentryczne koła) w grupie HBO. Żółte strzałki wskazują pęcherzyki autofagiczne.
(B) Półkwantyfikacja liczby pęcherzyków autofagicznych w grupie Sham, IR i grupie HBO (n = 5).
IR, niedokrwienie/reperfuzja; HBO,Tlen hiperbaryczny.
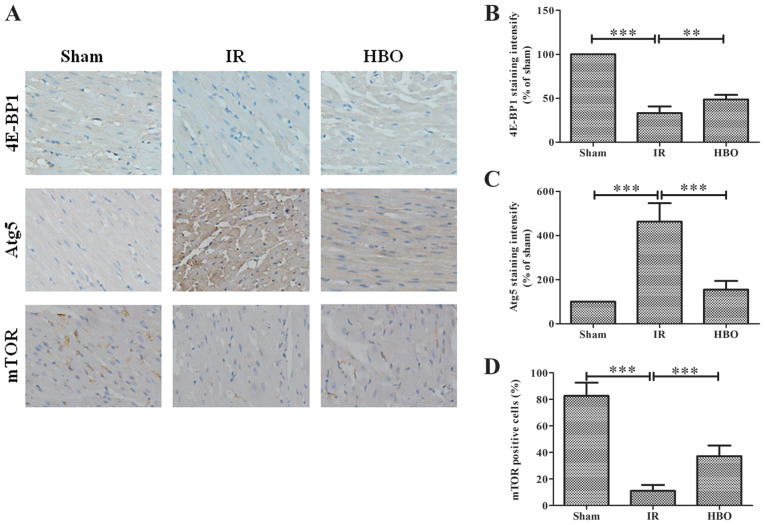
(A) Barwienie immunohistochemiczne odcinków mięśnia sercowego w celu wykrycia poziomów ekspresji 4E-BP1, Atg5 i mTOR w grupie Sham, IR i HBO. Jądro było zabarwione na niebiesko, a docelowe białko było zabarwione na brązowo.
Półkwantyfikacja poziomów ekspresji (B) 4E-BP1, (C) Atg5 i (D) mTOR w grupie Sham, grupie IR i grupie HBO. Dane są znormalizowane do grupy Sham i wyrażone w procentach.
IR, niedokrwienie/reperfuzja; HBO, tlen hiperbaryczny; Atg5, związany z autofagią 5; 4E-BP1, białko wiążące eukariotyczny czynnik inicjujący 4E 1; mTOR, ssak docelowy rapamycyny.
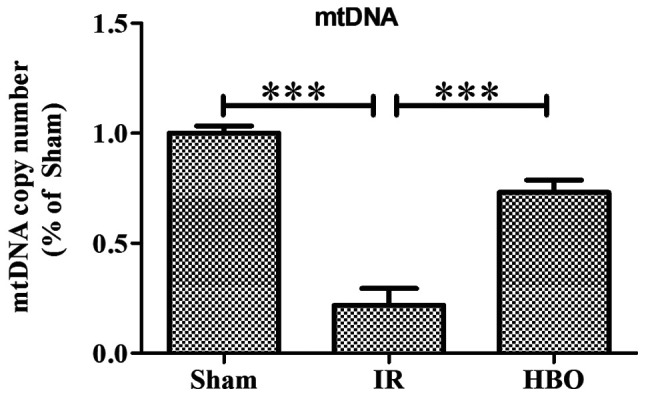
Dane są znormalizowane do grupy Sham i wyrażone w procentach. MtDNA, mitochondrialne DNA.
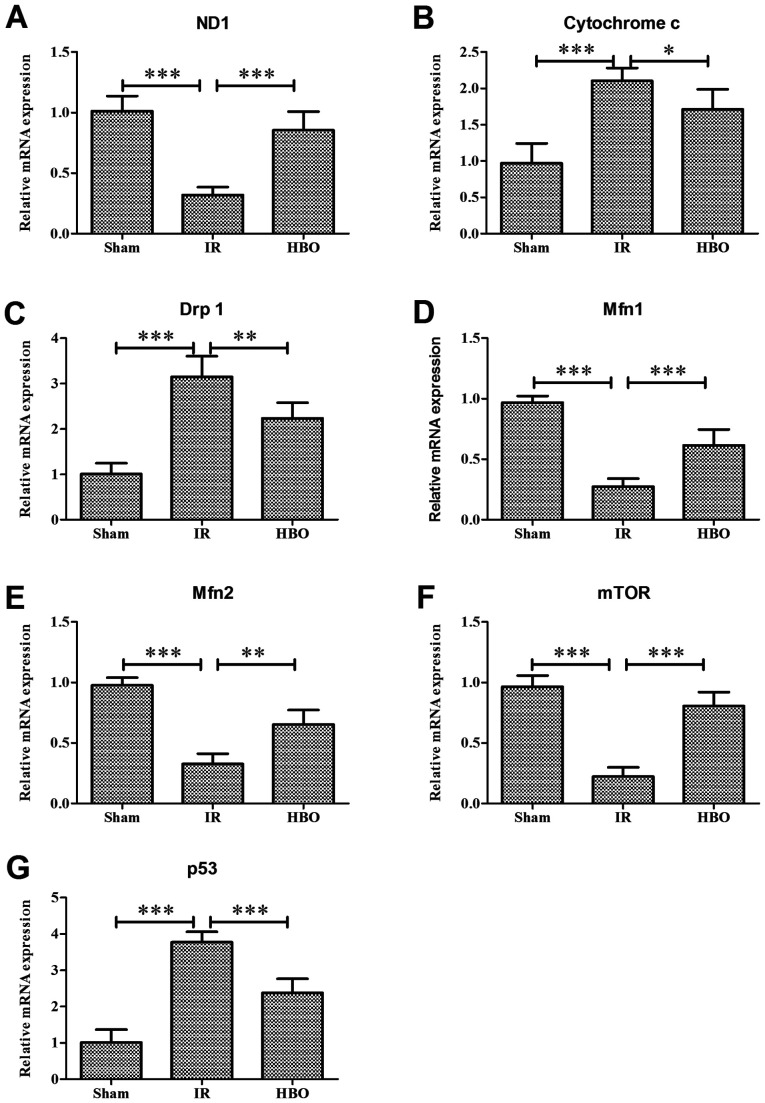
(AE) Wpływ wstępnej obróbki HBO na poziomy ekspresji mRNA genów związanych z dynamiką mitochondriów: (A) ND1, (B) cytochrom c, (C) Drp1, (D) mfn1 i (E) Mfn2 w grupie Sham i grupie IR And the HBO.
Wpływ HBOT na poziom ekspresji genów związanych z autofagią: (F) mTOR i (G) p53 były w grupie Sham, IR i HBO.
HBO, tlen hiperbaryczny; IR, niedokrwienie/reperfuzja; ND1, podjednostka dehydrogenazy NADH 1; Drp1, białko związane z dyneiną 1; Mfn1, mitofuzyna 1; Mfn2, mitofuzyna 2.
Podsumowując, zaobserwowano, że leczenie HBOT chroni kardiomiocyty podczas uszkodzenia reperfuzyjnego niedokrwienia mięśnia sercowego (MIRI), zapobiegając dysfunkcji mitochondriów i hamując autofagię.
Dlatego wyniki te dostarczają nowych dowodów na poparcie stosowania HBOT jako potencjalnej metody łagodzenia MIRI.
Cr: https://pubmed.ncbi.nlm.nih.gov/32901878/